เป็นวิธีการทางปริมาณวิเคราะห์ (Quantitative analysis) ใช้ในการหาปริมาตรของสารละลายมาตรฐาน ซึ่งเป็นสารละลายที่เราทราบความเข้มข้นที่แน่นอนแล้ว ที่ทำปฏิกิริยาพอดีกับสารละลายอื่นซึ่งทราบปริมาตร แต่ยังไม่ทราบความเข้มข้น เพื่อนำค่าปริมาตรที่ได้มาคำนวณหาความเข้มข้นของสารละลายอื่นนั้น
การไทเทรตกรด – เบส มีวัตถุประสงค์เพื่อหาจุดสมมูล (Equivalence point) ซึ่งเป็นจุดที่ปริมาตรของของกรดและเบสทำปฏิกิริยากันพอดี เพื่อนำไปใช้คำนวณหาความเข้มข้น จุดสมมูลของกรดและเบสในแต่ละคู่จะมีระดับ pH ที่แตกต่างกัน ขึ้นอยู่กับชนิดของกรดและเบส
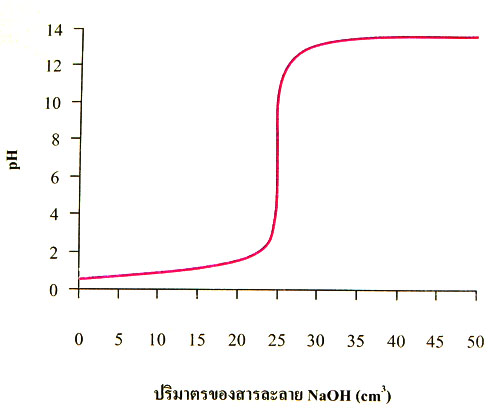
เมื่อนำข้อมูลที่ได้จากการไทเทรตระหว่างกรด HCl กับ NaOH มาเขียนกราฟแสดงความสัมพันธ์
ระหว่าง pH ของสารละลายผสม กับปริมาตรของสารละลาย NaOH ที่เติมลงไปควรได้กราฟดังภาพ
กราฟของการไทเทรตระหว่างสารละลายกรด HCI เข้มข้น 0.1 M จำนวน 25 cm3 กับสารละลาย NaOH เข้มข้น 0.1 M
กราฟของการไทเทรต คือกราฟแสดงการเปลี่ยนแปลง pH ที่ได้จากการไทเทรต ก่อนการไทเทรตสารละลาย HCl เข้มข้น 0.1 M จำนวน 25 cm3 ซึ่งมี pH 1 เมื่อไทเทรตด้วยสารละลาย NaOH เข้มข้น 0.1 M จะทำให้ปริมาณของ H3O+ ในสารละลายลดลง pH ของสารละลายจะเพิ่มขึ้นเรื่อย ๆ อย่างช้า ๆ จนถึงจุดยุติซึ่งเป็นภาวะที่อินดิเคเตอร์เปลี่ยนสี pH ของสารละลายจะเพิ่มขึ้นอย่างรวดเร็ว กราฟช่วงนี้จะมีความชันมากที่สุดและมีช่วง pH 3 – 11 ณ ภาวะนี้เมื่อเติมสารละลาย NaOH ลงไปเพียงหนึ่งหยดหรือเศษส่วนของหยดเท่านั้น ก็จะทำให้อินดิเคเตอร์เปลี่ยนเป็นสีม่วงน้ำเงิน
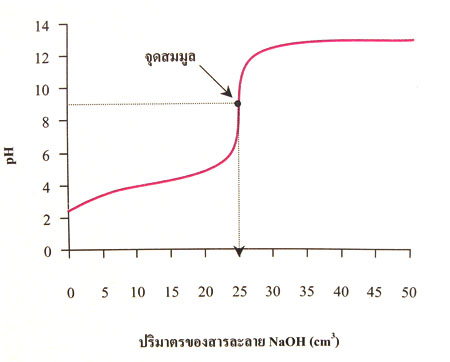
ภาพวิธีหาจุดสมมูลจากกราการไทเทรต
ถ้าแบ่งครึ่งเส้นกราฟส่วนที่ชันที่สุดแล้วลากเส้นจากจุดแบ่งครึ่งตั้งฉากกับแกนนอน จะตัดแกนนอนที่จุด 25 cm3 ดังภาพ แสดงว่าสารละลาย HCl เข้มข้น 0.1 M จำนวน 25 cm3 ทำปฏิกิริยาพอดีกับสารละลาย NaOH เข้มข้น 0.1 M จำนวน 25 cm3 ซึ่งสอดคล้องกับผลของการคำนวณ จุดแบ่งครึ่งเส้นกราฟส่วนที่ชันที่สุดนี้คือจุดสมมูล ซึ่งเป็นจุดที่สารละลาย NaOH ทำปฏิกิริยาพอดีกับ HCl
จากจุดสมมูล ถ้าลากเส้นขนานกับแกนนอนไปตัดแกนตั้งจะได้ pH เท่ากับ 7 แสดงว่า pH ที่จุดสมมูลของการไทเทรตระหว่างสารละลาย HCl กับสารละลาย NaOH มีค่าเท่ากับ 7 สารละลายผสมจึงควรมีสมบัติเป็นกลาง แต่จากการทดลอง 8.7 วัด pH ณ จุดยุติได้ประมาณ 7 – 8 เพราะว่าใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์ซึ่งเปลี่ยนสีในช่วง pH 8.3 – 10.0 และจากการทดลอง 8.8 วัด pH ของสารละลาย ณ จุดยุติได้ประมาณ 7 ดังนั้น pH ของสารละลายที่จุดสมมูลจึงมีค่าใกล้เคียงกับ pH ของสารละลายที่จุดยุติ
ในกรณีของการไทเทรตระหว่างกรดอ่อนกับเบสแก่ เช่น สารละลาย CH3COOH กับสารละลาย NaOH ซึ่งได้มีผู้ศึกษาทดลองไว้แล้วได้กราฟเป็นดังภาพ
กราฟของการไทเทรตสารละลาย CH3COOH เข้มข้น 0.1 M จำนวน 25 cm3 กับสารละลาย NaOH เข้มข้น 0.1 M
เมื่อพิจารณากราฟของการไทเทรตสารละลายกรดกับเบสทั้ง 2 ภาพ พบว่ามีรูปร่างคล้ายกันคือ pH จะเปลี่ยนอย่างช้า ๆ ในตอนแรก และจะเปลี่ยนอย่างรวดเร็วเมื่อใกล้จุดสมมูล แต่ส่วนที่แตกต่างกันคือ กราฟของการไทเทรต CH3COOH ด้วย NaOH มี pH ที่จุดเริ่มต้นสูงกว่า เนื่องจาก CH3COOH เป็นกรดอ่อน และช่วงที่กราฟมีความชันมากที่สุดสั้นกว่าคือมีช่วง pH 6 – 11 เมื่อหา pH ที่จุดสมมูลจะได้ค่าสูงกว่า 7 คือประมาณ 8.7
VDO ตัวอย่างการไทเทรต